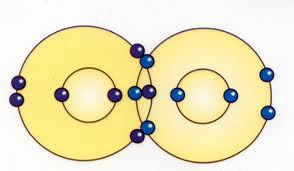
EL ENLACE QUÍMICO
Es la fuerza de atracción mutua entre dos o más átomos que se combinan para formar moléculas.
Es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
Distribución electrónica en los átomos
Los electrones dentro del átomo se pueden distribuir en niveles principales, subniveles y orbitales. La manera como se distribuyen los electrones es a través de la configuración electrónica. En el orden en que se van llenando los niveles.
ELECTRONES DE VALENCIA
Los electrones de valencia son los electrones que se encuentran en los mayores niveles de energía del átomo, siendo éstos los responsables de la interacción entre átomos de distintas especies o entre los átomos de una misma. Estos presentan la facilidad de formar enlaces, pueden darse de diferente manera, ya sea por intercambio de estos electrones, por compartición de pares entre los átomos.
ORBITAL
Podemos decir que un orbital atómico es una zona del espacio donde existe una alta probabilidad de encontrar al electrón. Esto supone considerar al electrón como una nube difusa de carga alrededor del núcleo con mayor densidad en las zonas donde la probabilidad de que se encuentre dicho electrón es mayor.
HIBRIDACIÓN
Hibridación cuando en un átomo, se mezcla el orden de los electrones entre orbitales creando una configuración electrónica nueva, un orbital híbrido que describa la forma en que en la realidad se disponen los electrones para producir las propiedades que se observan en los enlaces atómicos.
GEOMETRIA MOLECULAR
Geometría molecular o estructura molecular es la disposición tri-dimensional de los átomos que constituyen una molécula. Determina muchas de las propiedades de las moléculas, como son la reactividad, polaridad, fase, color, magnetismo, actividad biológica
INTERACCIÓN INTERMOLECULAR
Fuerzas de atracción entre moléculas: A veces también reciben el nombre de enlaces intermoleculares aunque son considerablemente más débiles que los enlaces iónicos, covalentes y metálicos
Las principales fuerza
Las fuerzas de Van der Waals. a su vez se divide en: Dipolo- Dipolo, Dipolo - Dipolo inducido, Fuerzas de dispersión de . London
Enlace de hidrógeno (antiguamente conocido como puente de hidrógeno)
ENLACE QUIMICO:
Es la fuerza existente dos o más átomos que los mantiene unidos en las moléculas.
TIPOS DE ENLACE
TIPOS DE ENLACE
Enlace iónico: si hay atracción electrostática.
Enlace covalente: si comparten los electrones.
Enlace covalente coordinado: cuando el par de electrones es aportado solamente por uno de ellos.
Enlace metálico: son los electrones de valencia pertenece en común a todos los átomos.
PROPIEDADES PERIÓDICAS
Son propiedades que presentan los elementos químicos y que se repiten secuencialmente en la tabla periódica. Por la colocación en la misma de un elemento, podemos deducir que valores presentan dichas propiedades así como su comportamiento químico.
LA ELECTRONEGATIVIDAD
La electronegatividad varía de la siguiente forma:
Son propiedades que presentan los elementos químicos y que se repiten secuencialmente en la tabla periódica. Por la colocación en la misma de un elemento, podemos deducir que valores presentan dichas propiedades así como su comportamiento químico.
LA ELECTRONEGATIVIDAD
La electronegatividad es la capacidad que tienen los elementos de atraer hacia sí los electrones de enlace.
La electronegatividad varía de la siguiente forma:
· Para un mismo grupo la electronegatividad disminuye de arriba hacia abajo.
· En un mismo periodo la electronegatividad aumenta de izquierda a derecha.
Chemical bonds
Underlying many of the properties found in ceramics are the strong primary bonds that hold the atoms together and form the ceramic material. These chemical bonds are of two types: they are either ionic in character, involving a transfer of bonding electrons from electropositive atoms (cations) to electronegative atoms (anions), or they are covalent in character, involving orbital sharing of electrons between the constituent atoms or ions. Covalent bonds are highly directional in nature, often dictating the types of crystal structure possible. Ionic bonds, on the other hand, are entirely nondirectional. This nondirectional nature allows for ...
in chemistry, the interatomic linkage that results from the sharing of an electron pair between two atoms. The binding arises from the electrostatic attraction of their nuclei for the same electrons. A covalent bond forms when the bonded atoms have a lower total energy than that of widely separated atoms.
A brief treatment of covalent bonds follows. For full treatment, see chemical bonding: Covalent bonds.
Molecules that have covalent linkages include the inorganic substances hydrogen, nitrogen, chlorine, water, and ammonia (H2, N2, Cl2, H2O, NH3) together with all organic compounds. In structural representations of ... (100 of 343 words)
revista Britannica
revista Britannica
autor
in full John Sidney McCain
BIBLIOGRAFIA