SEGUNDOS MENSAJEROS
La transducción de señal es el conjunto de procesos o etapas que ocurren de forma concatenada por el que una célula convierte una determinada señal o estímulo exterior, en otra señal o respuesta específica.
Uno de los principios básicos en la transducción de lasñales es la amplificación de señal que ocurre al pasar de un componente a otro a través de las vías de señalamiento. Esta se logra a través de los segundos mensajeros o mediadores intracelulares, a un grupo de moléculas pequeñas que acarean la información codificada por los mensajeros extracelulares hacia blancos intracelulares responsables de la respuesta biológica.
En la mayoría de los casos los segundos mensajeros tiene vida media corta y son rápidamente degradados y resintetizados. Esto quiere decir que las células poseen un mecanismo para degradar eficientemente nucleótidos cíclicos y para amortiguar y mover el calcio citosólico.
La interacción del ligando a sus receptores activa a las proteínas efectoras que se encuentran cerca de la membrana, lo que les permite catalizar la transformación de moléculas precursoras en segundos mensajeros, estos funcionan como efectores alostéricos es decir son reconocidos con una extraordinaria afinidad y especificidad por ciertas proteínas cinasas las que a su vez fosforilan o tras proteínas de la célula activando o inhibiendo otras cinasas o fosfatasas. Cuando alguna de estas cinasas tiene varias proteínas blanco, la vía de señalamiento se ramifica, contribuyendo de esta manera a una cascada de eventos que amplifican la señal al interior de la célula y contribuyen a la diversidad de respuestas celulares.
DOS DE LOS SEGUNDOS MENSAJEROS MÁS UTILIZADOS POR LAS CÉLULAS SON:
SEGUNDO MENSAJERO AMP CÍCLICO SE FORMA A PARTIR DE ATP
El AMPc es un segundo mensajero, empleado en las rutas de transducción de la señal en las células como respuesta a un estímulo externo o interno, como puede ser una hormona como el glucagón o la adrenalina, o una respuesta de regulación postraduccional. Suele estar relacionado con la activación de proteína kinasas variadas.
Fue identificado como un mediador intracelular de acción hormonal y se ha establecido que tiene esta función tanto en las células eucariotas como en las procariotas.
Para actuar como segundo mensajero, el nivel de AMP cíclico es capaz de subir o bajar considerablemente en respuesta a estímulos extracelulares; esta capacidad esta mediada por la rápida síntesis de la adenilatociclasa y equilibrada por una rápida hidrólisis.
SEGUNDO MENSAJERO CA ++
El calcio está implicado en múltiples procesos como la contracción muscular, la liberación de neurotransmisores desde las terminaciones nerviosas, la visión en las células de la retina, proliferación, secreción, funcionamiento del cito esqueleto, movimiento celular, expresión.
El calcio actúa como una Molécula de señal dentro de la célula., Cuando el calcio es liberado y por lo tanto es activo, actúa en un espacio muy limitado de tiempo. Por lo tanto la concentración de ion calcio dentro de la célula es muy bajo (0.1micromoles).
Ø La ruta que involucra al calcio como segundo mensajero
Ø inicia cuando un estimulo extracelular es captado por el receptor.
Ø El receptor una vez activado se une a una proteína G trimerica haciendo que la subunidad alfa se disocie y active la fosfolipasa
Ø La activación de este sistema permitiría la hidrólisis de ciertos compuestos lipídicos normales de la membrana celular, como el fosfolípido, fosfatidilinositol 4,5 di fosfato (PIP2), generándose así dos segundo mensajeros: inositol trifosfato (IP3) y 1,2 diacilglicerol (DAG)
PROPUESTA
Me gustaria que hubiera implementado en la clase algun video donde nos explique el mecanismo de señalizacion ya por que por medio de las diapositivas no fue muy claro.
BIBLIOGRAFIA DE APOYO
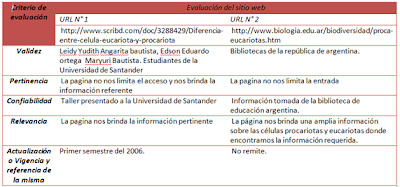
ANONIMO, Biologia, [en linea] http://iescarin.educa.aragon.es/estatica/depart/biogeo/varios/BiologiaCurtis/Indice%20de%20secciones.htm [citado el 30 de octubre de 2010]
BRANDAN, Nora, et al. Receptores hormonales. [en linea] http://med.unne.edu.ar/catedras/bioquimicaanterior/receptor.htm [citado el 30 de octubre de 2010].
CORTEZ Carlos, Transduccion de señales Ca++ /Inositol Trifosfato [en linea] http://www.scribd.com/doc/24580273/Ion-Calcio-Como-Segundo-Mensajero [citado el 30 de octubre de 2010].
COOPER, Geoffrey et al . La célula: Mediadores y segundos mensajeros. 5ta ed.Madrid: Marbán libros, S.L, 2009. 818.pag.


![[mono76.txt]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgrHlpkoM2C8hVIpdelGggAmAokr8byb-Euc0tH8oJcK6x___OEcgIG1pZhFICsUn3jp6iSBuOi36_iDudjtSHmn7mjNFSu6zOVXm8ELCIqn_5G8X5tY8e-8a37vGQbjsW66sxdu8UVzZcH/s320/mono76.txt)
![[mono77.txt]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjOdo11r1w2sNFhpHlE1z-oYDEyJUYVnnHGXzWBVM5_8dKJUyCY7YDx4ARpwmaVyjnKkFZM4ibWLUkmrPqDlLWzQxq1BHZSbZH6_qI2fK9T9OjjLy5O-F_woZRwy8p6ElIT3tY7LEyxfuCX/s320/mono77.txt)